Soğuk atmosferik plazmanın dental uygulamaları
Titanyum yüzeye uygulanan
plazma işleminin implant malzemesini çevreleyen doku üzerindeki etkisi
Yazarlar: Hitomi Tsujita, Hiroshi Nishizaki, Akiko
Miyake, Seiji Takao, Satoshi Komasa
Yayın: Tsujita, H.; Nishizaki, H.; Miyake, A.;
Takao, S.; Komasa, S. Effect of Plasma Treatment on Titanium Surface on the
Tissue Surrounding Implant Material. International Journal of Molecular Sciences,
2021, 22, 6931. doi: 10.3390/ijms22136931.
Aşağıdaki metin, AIR (activatio
İmplant yerleştirildikten sonra ilk
stabiliteyi sağlamak için erken osseointegrasyon (canlı kemik ile yük taşıyan
yapay bir implantın yüzeyi arasındaki doğrudan yapısal ve fonksiyonel bağlantı)
önemlidir. Atmosferik basınçlı plazma işleminin titanyuma süper hidrofiliklik
kazandırdığı daha önce tarafımızdan bildirilmiştir. Bu çalışmada, atmosferik
basınçlı plazma işlemiyle süperhidrofiliklik kazandırılan titanyum implant
malzemesinin, sıçan femurunda çevre doku üzerindeki etkileri incelenmiştir.
Kontrol ve deney grupları sırasıyla, plazma işlemine tabi tutulmamış ve
piezobrush kullanılarak atmosferik basınçlı plazma işlemine tabi tutulmuş olan
vidaları içermektedir. İn vivo deneyler için 8 haftalık erkek Sprague-Dawley
sıçanlarının femurları kullanılmıştır. Mikro-CT analizinden hazırlanan çeşitli
veriler, test grubunda kontrol grubuna göre daha fazla yeni kemiğin oluştuğunu
yansıtan sonuçlar göstermiştir. Benzer sonuçlar histolojik analizde de
gösterilmiştir. Sonuç olarak, atmosferik basınçlı plazma ile işleme tabi
tutulan titanyum vida, in vivo düzeyde bile yüksek sert doku farklılaşmasını
sağlayabilmiştir. Bu yöntem, implant yerleştirilmesinden sonra ilk stabiliteyi
sağlamak için faydalı olabilecektir. n
image recording) yönteminin çeşitli teknik sorunları çözmek için nasıl
kullanılabileceğini gösteren bir araştırma çalışmasını özetlemektedir.
Birçok araştırmacı, implant
malzemelerinin yüzey modifikasyonunun, arayüzde kemik oluşumunu ve onarımını
etkilediğini ve dolayısıyla osseointegrasyonda önemli bir rol oynadığını
göstermiştir [1–5]. Çok sayıda bildiri, malzeme yüzeyleri ve çeşitli hücreler
arasındaki ilişkiyi araştırmıştır [6-11]. Malzeme yüzeyinin yüzey
pürüzlülüğündeki değişikliklerin, artan kemik iliği hücre yapışmasına ve
farklılaşmasına katkıda bulunduğu bildirilmiştir. İmplantların ana
malzemelerinden biri olan titanyum yüzeyinin yüzey pürüzlülüğünde bir artış
olduğunda, başlangıçtaki yapışma, çoğalma, kemikle ilgili hücrelerin
farklılaşması ve protein emiliminin de arttığı bildirilmiştir [12-15]. Komasa
ve diğ. ultraviyole (UV), atmosferik basınçlı plazma ve alkali işlemleri ile
modifiye edilen titanyum ve nano yapılı zirkonya/alümina kompozit (NANOZR)
implant malzemelerinin, implantı çevreleyen dokuda erken sert doku oluşumunu
destekleyebileceğini bildirmişlerdir [16-25]. Yaygın olarak kullanılan diğer
yüzey işleme yöntemleri arasında asitle aşındırma, kumlama, anotlama, fiziksel
buhar biriktirme (PVD), kalsiyum fosfat kaplama ve hidroksiapatit (insan diş ve
kemiklerinde bulunan doğal bir kalsiyum minerali, kalsiyum fosfat hidroksit)
kaplama bulunmaktadır [1–11].
Hidrofilizasyon, titanyum
malzemeler için klinisyenler (klinik tedavi uzmanları) tarafından uygulanabilen
bir yüzey işleme yöntemi olarak bilinmektedir [26-28]. Malzeme yüzeyinin
süperhidrofilik işlemi, hücre bağlanma proteinlerinin ve kemik proteinlerinin
yapışmasını arttırmaktadır [29,30]. İmplant çevresindeki osseointegrasyonun,
epitel adezyonun baskılanmasının ve yumuşak dokunun bakteriyel adezyonunun
indüklendiği bildirilmiştir ve klinik uygulamalar büyük bir beklentidir. Bir
malzemenin yüzeyine hidrofiliklik kazandırmak için uygulanan fiziksel
modifikasyon yöntemlerinin örnekleri arasında düşük sıcaklıklı atmosferik
basınçlı plazma yöntemi ve ultraviyole (UV) ışınlama yöntemi yer almaktadır.
Kimyasal modifikasyon yöntemleri arasında hidrojen peroksit çözeltisine daldırma
yöntemi ve NaOH çözeltisi ile işleme yöntemi bulunmaktadır [31,32]. Ancak
klinisyenlerin dikkatini çeken yöntemler, düşük sıcaklık atmosferik basınçlı
plazma işlemi ve UV işlemi gibi malzeme kontaminasyon riski düşük olan fiziksel
modifikasyon yöntemleridir. Düşük sıcaklıklı atmosferik basınçlı plazma
yönteminde, serbest moleküller, plazma oluşturmak için düşük voltaj altında
zayıf bir elektrik alanı ile ayrışmaktadırlar. Örneğin plazma işlemi,
atmosferik basınç altında, havaya yüksek bir voltaj uygulandığı için iyonize
elektronlar ve katyonlar üretmektedir [33-36]. Ozon plazma tarafından
oluşturulur ve plazmadan üretilen aktif oksijenin redoks reaksiyonu, organik
maddenin ayrışmasına neden olur ve hidroksil grupları üretir. UV ışınlama
yönteminde, fotokataliz yoluyla üretilen oksijen radikalleri, organik
bileşiklerin moleküler bağlanma bölgelerinde hemen oksitlenir, UV ışınlaması
ile parçalanır ve hidroksil grupları oluşturur. Bu reaksiyonlar yüzeyi aktive
eder ve Van der Waals kuvveti ile yüzeyin yapışkanlığını ve ıslanabilirliğini
iyileştirir. Her iki yöntemin de yararlılığını inceleyen az sayıda çalışma
olmasına karşın, kuvars kristal mikro balans (Quartz Crystal Microbalance, QCM)
sisteminin kullanıldığı son araştırmada Matsumoto ve diğ. bu yöntemi titanyum
yüzeyler için bir işlem olarak incelemişlerdir [37]. Materyal yüzeyine
damlatıldıktan hemen sonra zaman içinde gözlemlendiğinde, osseointegrasyona
dahil olan materyalin, plazma ile işlenmiş titanyum yüzeyinde yüksek yapışma
dayanımı gösterdiği açıklığa kavuşturulmuştur [37].
Plazma işleminin uygulama yelpazesi
genişlemeye devam etmektedir ve sadece diş alanında değil, aynı zamanda diğer
çeşitli alanlarda da uygulanmaktadır. Titanyum yüzeyine uygulanan plazma
işleminin implantı çevreleyen dokuyu nasıl etkilediği çeşitli yayınlarda
incelenmiştir [38-40]. Plazma işleminin etkisi, ablasyon ve malzeme yüzeyindeki
yüzey aktivitesinin etkileri ile hidrofobik malzemeleri hidrofilik hale
getirmektir. Plazma işleminin malzeme yüzeyi üzerindeki etkisi açıklığa
kavuşturulmuş olmakla birlikte, cihazların büyük boyutu klinisyenler için
dezavantajlıdır. Bu çalışmada kullanılan cihaz piezobrush'tır. Bu cihaz pratik
bir model olduğu için günlük klinik pratikte oldukça kullanışlıdır. Geçmiş
bildirilerde, Ujino ve diğ., titanyumun bu cihazla işlenmesinin, malzemenin
yüzeyindeki kirleticileri ortadan kaldırdığını ve hidrofiliklik kazandırdığını
göstermişlerdir [41]. Plazmayla işlenmiş olan bu yüzeyin, sıçan kemik iliği
hücrelerinin (RBMC'ler) başlangıç yapışmasını ve farklılaşma indüksiyonunu
teşvik ettiği de açıklanmıştır [41]. Ek olarak, Takao ve diğ. ve Zeng ve diğ.,
bu cihazı kullanmış ve metal alerjisi olan hastalarda kullanılması beklenen hem
titanyum hem de NANOZR üzerinde plazma işleminin etkisini netleştirmişlerdir
[42,43]. Ancak klinisyenlerin piezobrush'ı güvenle kullanabilmeleri için
atmosferik basınçlı plazma işleminin implantı çevreleyen dokular üzerindeki
etkileri in vivo düzeyde incelenmelidir. Atmosferik basınçlı plazma işleminin
in vitro ve in vivo seviyelerde implant materyalleri üzerinde nasıl bir etki
yarattığı konusunda daha ileri çalışmalara ihtiyaç vardır.
Bu çalışmada, piezobrush ile plazma
işlemine tabi tutulan titanyum vidaların, implantı çevreleyen doku üzerindeki
etkisi incelenmiştir.
2.1. Numune
Hazırlama
Titanyum yüzeyine uygulanan atmosferik basınçlı
plazma işleminin malzemenin yüzeyini nasıl etkileyeceği araştırılmıştır.
Taramalı elektron mikroskobu (SEM) analiz sonuçları Şekil 1'de gösterilmiştir.
Titanyum vidanın yüzey yapısında plazma işleminden dolayı oluşan herhangi bir
farklılık gözlenmemiştir. X-ışını fotoelektron spektroskopisi (XPS) analiz
sonuçları Şekil 2'de gösterilmiştir. Test grubu karbonda bir azalma
göstermiştir, bu sonuç malzemenin yüzeyinde bir kirletici olduğuna işaret
etmektedir. Titanyum vidanın yüzeyindeki temas açısı sonuçları Şekil 3’te
görülmektedir. Test grubunun temas açısı 32° iken deney grubu
süperhidrofiliklik göstermiştir.

Şekil 1. Titanyum vidanın SEM görüntüleri. Plazma işlemi uygulanmış
numuneler; (a,c), plazma uygulanmamış numuneler; (b,d). İmplant yüzeyi düşük
(x50) ve yüksek (x200) büyütme ile incelendiğinde plazma işlemi sebebiyle
malzeme yüzeyinde herhangi bir mekanik değişiklik olmadığı gözlenmiştir.

Şekil 2. Titanyum vidanın XPS
analiz sonuçları. Plazma işlemi uygulanmış numuneler; (sol), plazma
uygulanmamış numuneler; (sağ). Atmosferik basınçlı plazma işlemi uygulanan
implant yüzeyinde oksijen pikinde artış ve karbon pikinde azalma gözlenmiştir.

Şekil 3. Saf suyun
damlatıldığı implant yüzeyinin görüntüsü. Plazma işlemi uygulanmış numuneler;
(a), plazma uygulanmamış numuneler; (b). Temas açısı ölçüldüğünde, plazma
uygulanmamış implant yüzeyi hidrofobiklik gösterirken, plazma işlemi uygulanmış
implant yüzeyi süperhidrofiliklik göstermiştir.
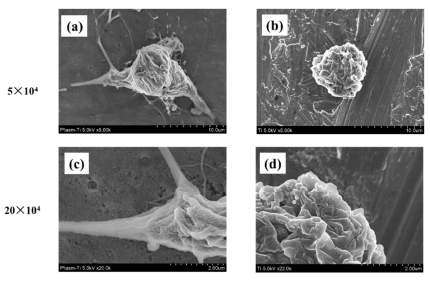
Şekil 4. Titanyum disklerdeki
RBMC’lerin SEM görüntüleri. Plazma işlemi uygulanmış numuneler; (a,c), plazma
uygulanmamış numuneler; (b,d). Plazma işlemi uygulanmış veya uygulanmamış
titanyum yüzeyinde RBMC'lerin yapışması gözlenmiştir. İşlenmemiş titanyum
yüzeyinde RBMC'lerin hücre prosesinde herhangi bir uzantı oluşumu
gözlenmemiştir. Ancak, plazma işlemi ile RBMC'lerin morfolojisindeki
değişiklikler gözlenmiştir. Yüksek büyütmede incelendiğinde, hücre sürecinde
uzantılar izlenmiştir.
2.2. Hücre Morfolojisi
Titanyum diskin yüzeyine tutturulan
RBMC'lerin (Rat Bone Marrow Cells; sıçan kemik iliği hücreleri) morfolojisi,
kültürlemeden 6 saat sonra gözlenmiştir (Şekil 4). Atmosferik basınçlı plazma
işleminin varlığına veya yokluğuna bağlı olarak titanyum yüzeyine ekilen
hücrelerin şeklinde oluşan değişiklikler incelenmiştir. RBMC'lerin oval şekli,
işlenmemiş titanyum diskte açıkça görülmüştür. Güçlü genişlemenin gözlemlenmesi
sırasında filamentli psödopodia (hareket ve beslenme için hücre yüzeyinde
oluşan kol benzeri çıkıntılar) görülmemiştir. Atmosferik basınçlı plazma ile
işlenmiş titanyum yüzeyindeki RBMC'lerin morfolojisi bir iğ şekline sahiptir.
Güçlü genişleme gözlemleri, filamentli psödopodianın kazanıldığını ortaya koymuştur.
Atmosferik basınçlı plazma işlemi uygulanarak hücre yapışmasının arttırıldığı
açıkça ortaya konulmuştur.
2.3. RBMC'ler için Hücre İçi ROS Seviyesi
Plazma işlemi uygulanmış titanyum
yüzeyindeki RBMC'lerde hücre içi reaktif oksijen türleri (ROS; Reactive Oxygen
Species) gözlenmemiştir. Plazma işlemi yapılarak malzemenin yüzeyinde aktif
oksijenin üretildiği ve hücrelerin kolayca büyüyebileceği bir ortamın oluştuğu
gösterilmiştir (Şekil 5).
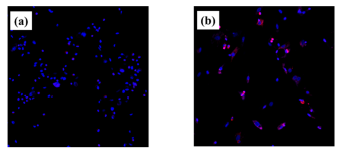
Şekil 5. Titanyum disklerdeki
RBMC’lerin ROS görüntüleri. Plazma işlemi uygulanmış numuneler; (a), plazma
uygulanmamış numuneler; (b). Her iki grupta da titanyum yüzey formuna
RBMC'lerin yapışması gözlenmiştir (mavi; RBMC’lerin DNA’sı). Plazma
uygulanmamış titanyum numuneleri üzerindeki RBMC’lerde ROS izlenmiştir (pembe;
ROS). Atmosferik basınçlı plazma ile işlenen titanyum yüzeyinde ROS varlığı
ayırt edilmemiştir.
2.4. Titanyum Yüzeylerde Plazma Kaynaklı In Vivo Kemik Farklılaşması
Şekil 6, implantasyondan 8 hafta
sonra çıkarılan sıçan femurunun üç boyutlu bilgisayarlı tomografi (CT) ile
yapılan analiz sonuçlarını göstermektedir. CT görüntülerinden test grubunun
büyük miktarda yeni kemik oluşumu sergilediği anlaşılmaktadır. İlgili bölge
(ROI) içindeki nicel değerlendirme Şekil 7'de gösterilmiştir. ROS analizi sonuçlarından,
implant çevresindeki yeni kemik miktarının, atmosferik basınçlı plazma ile
işlenen titanyum vidada, plazma uygulanmayan gruptan önemli ölçüde daha üstün
olduğu görülmektedir (Şekil 7).
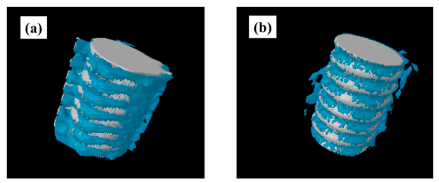
Şekil 6. İmplantasyondan 8
hafta sonra çıkarılan, sıçan uyluk kemiği (femur) etrafındaki titanyum vidanın
CT görüntüleri. Plazma işlemi uygulanmış numuneler; (a), plazma uygulanmamış
numuneler; (b). Plazma uygulanan implantların CT görüntüleri büyük miktarda
yeni kemik oluşumu göstermiştir.
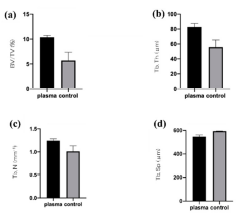
Şekil 7. Kemik hacmi
(BV)/doku hacmi (TV) (a), ortalama trabeküler sayı (Tb.N) (b) ve ortalama
trabeküler kalınlık (Tb.Th) (c) kontrol implant grubuna kıyasla test implant
grubunda anlamlı olarak daha yüksektir (p < 0.05). Diğer yandan, ortalama
trabeküler ayrılma (Tb.Sp) (d), plazma uygulanmamış implantlara kıyasla plazma
uygulanan titanyum implantlarda önemli ölçüde daha düşük bir değer
sergilemiştir.
İmplantın yerleştirildiği femurdan
hazırlanan kalsiyum uzaklaştırma yapılmamış bir numune Şekil 8'de
gösterilmektedir. Şekil 8'de plazma ile işlenmiş titanyum implant vidasının
yüzeyinde oluşan yeni kemik miktarının büyük olduğu açıkça görülmektedir. Bu
ölçüm alanında yapılan nicel analizin sonucu Şekil 9'da gösterilmiştir. Nicel
analizle hesaplanan kemik alanı (BA) ve kemik implant temas (BIC) değerleri
deney grubunda önemli ölçüde daha yüksektir (p < 0.05).
İmplantasyondan 4 ve 8 hafta sonra
floresan etiketler enjekte edilmiş ve bir konfokal lazer tarama mikroskobu ile
dinamik doku morfometrisi gözlemlenmiştir. Alizarin kırmızısı S’i (4 hafta) ve
oksitetrasiklin hidroklorürü (8 hafta) temsil eden renkli lineer sinyaller
gösterilmiştir. Floresanla boyanmış yeni kemikler arasındaki mesafenin her
ölçüm zamanında gözlenmesi, plazma işlemi uygulanmış titanyum implant vida yüzeyinde
oluşan yeni kemik miktarının tüm haftalarda yüksek olduğunu göstermiştir (Şekil
10). Ayrıca, bu analiz görüntüsünün nicel analizi, deney grubunda etiketli
antikorla boyanmış kemik alanı (işaretli kemik alanı yüzdesi; %LBA) oranının
yüksek olduğunu göstermiştir. Ek olarak, plazma ile işlenen grubun, nispeten
erken oluşan büyük miktarda yeni kemiğe sahip olduğu görülmektedir (Şekil 11).
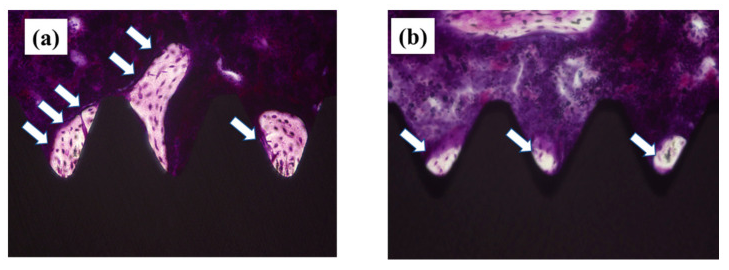
Şekil 8. İmplantasyondan 8
hafta sonra implant çevresindeki kemik dokusunun histopatolojik görüntüsü.
Plazma işlemi uygulanmış numuneler; (a), plazma uygulanmamış numuneler; (b).
Beyaz okla gösterilen kısım yeni kemik oluşumunu göstermektedir. Şekilde plazma
ile işlenen implant vidasının çevresinde oluşan yeni kemik miktarının fazla
olduğu görülmektedir.

Şekil 9. Plazma işlemli ve
işlem görmemiş titanyum vidalarda implant çevresinde yeni oluşan kemiğin
analizi. Her iki ölçümün sonuçlarından kemik alanı oranı (BA) (a) ve
kemik-implant temasının (BIC) (b) kantitatif histomorfometrik analizi
kullanılarak, plazma işlemi uygulanmış implant malzemesinin yüzeyinde oluşan
yeni kemik miktarının büyük olduğu netleştirilmiştir.

Şekil 10. Konfokal lazer
tarama mikroskobu ile gözlenen floresan etiket ve dinamik doku morfometrisi.
Plazma işlemi uygulanmış numuneler; (a), plazma uygulanmamış numuneler; (b).
Kırmızı doğrusal sinyal implantasyondan 4 hafta sonrasını ve mavi doğrusal
sinyal implantasyondan 8 hafta sonrasını göstermektedir. Çizgiler arasındaki
mesafe ile gösterilen yeni kemik kütlesinin, plazma ile işlenmiş titanyum
implant yüzeyinde yüksek olduğu görülmektedir.

Şekil 11. Etiketli antikor
ile boyanmış kemik bölgesinin nicel analiz sonucu. İmplantasyondan 4 ve 8 hafta
sonra yapılan her iki analiz sonucu, atmosferik basınçlı plazma işlemi
uygulanan grubun büyük miktarda yeni kemik oluşumuna sahip olduğunu ortaya
çıkarmıştır (p < 0.05).
Daha önceki çalışmalarda in vitro
düzeyde titanyum metal yüzeyinde piezobrush kullanılarak yapılan plazma
işleminin implantı çevreleyen dokuda sert doku oluşumuna katkı sağladığı
tarafımızdan gösterilmişti. Bu yöntem titanyum implant vidasına uygulanıp sıçan
uyluk kemiğine implante edildiğinde, implant malzemesinin yüzeyi çevresinde
önemli miktarda yeni kemik oluştuğu ortaya konulmuştur. Atmosferik basınçlı
plazma uygulanan titanyum yüzey incelendiğinde, malzeme yüzeyine hidrofiliklik
kazandırıldığı, titanyum yüzeyindeki oksidatif stresin azaldığı ve hücre
uzamasının varlığı gözlemlenmiştir. Daha önceki raporlara ek olarak bu sonuç,
atmosferik basınçlı plazma işleminin klinisyenlere önerilebilecek bir yöntem
olduğunu düşündürmektedir.
İmplant yüzeyinin özellikleri,
yalnızca hücre yapışması ve gelişimi üzerinde değil, aynı zamanda hücre
farklılaşması ve ekspresyonu üzerinde de derin etkiye sahiptir. Genel olarak,
pürüzlü bir yüzey, ayna gibi bir yüzeyden daha güçlü bir hücre yapışma
kuvvetine sahiptir. Önceki çalışmalarda, titanyuma konsantre alkali
uygulamasının, titanyum yüzeyinde nanometre ölçekli bir mekanik yapı
oluşturduğu, bunun da RBMC'lerin ilk yapışma kabiliyetini ve sert doku
farklılaşmasını indükleme kabiliyetini geliştirmeye yardımcı olduğu
tarafımızdan gösterilmişti [16-18]. Aynı zamanda, malzeme yüzeyinin yüzey
dokusunun, RBMC'lerin ilk yapışması ve kinetiğinde büyük ölçüde etkili olduğu
ifade edilmişti. Yüzey özellikleri arasında hidrofilikliğin, hücre yapışması
ile büyük bir korelasyonu olduğu belirtilmişti. Birçok çalışma, hücrelerin ilk
yapışmasının, çoğalmasının ve farklılaşmasının yüksek hidrofilik malzemelerin
yüzeyinde artma eğiliminde olduğunu bildirmiştir [1-10]. Genel olarak UV işlemi ve atmosferik basınçlı
plazma işlemi, implant malzemesinin yüzeyine hidrofiliklik kazandırabilen
klinik yöntemlerin örneklerindendir [44-47]. Bunlar arasında atmosferik
basınçlı plazma işlemi, genellikle iyonlaştırıcı elektronlar ve katyonlar
olgusunu kullanarak, esasen oksijene yüksek bir voltaj uygulama yoluyla malzeme
modifikasyonu için kullanılmaktadır. Hızlandırılmış elektronlar, aktif oksijen
üretmek için oksijen moleküllerinin atomlar arası bağlarını koparır. Atmosferik
basınçlı plazma işleminin mekanizması, bu aktif oksijenin, malzemenin yüzeyinde
adsorbe edilen hidrofobik organik maddeleri ayrıştırması ve malzeme yüzeyine
süper hidrofiliklik kazandırmasıdır. Önceki çalışmalarda, titanyum yüzeye
piezobrush kullanarak atmosferik basınçlı plazma işlemi uygulanmasının,
RBMC'lerin ilk yapışmasını ve sert doku farklılaşmasını indükleme kabiliyetini
geliştirmek için in vitro düzeyde yararlı olduğu tarafımızdan bildirilmişti
[41-44]. Bu çalışmada, titanyum yüzeyler üzerinde atmosferik basınçlı plazma
işleminin etkisi in vivo değerlendirme için araştırılmıştır. Ujino'nun [41]
çalışmasına benzer şekilde, titanyum vidanın yüzey yapısı değişmemiştir ve
karbonun malzeme yüzeyinin süperhidrofilik olduğunu belirten yüzeydeki kontaminasyon
durumunu gösterdiği gözlenmiştir. Plazma işlemi, implant malzemeleri olan temel
titanyum ve zirkonya materyalinin yüzeyine hidrofilik fonksiyonel gruplar
getirir. Osseointegrasyonda yer alan çeşitli hücreler ve proteinler nakledilen
implant malzemesinin yüzeyine yapışır. Bu öğelerin, hidrofiliklik kazandırılan
malzeme yüzeyinde kolayca adsorbe edildiği bildirilmiştir. Malzemenin yüzeyine
hidrofiliklik kazandırmak için yüzeydeki kirleticilerin çıkarılması ve yüzey
enerjisinin arttırılması gereklidir. UV işlemi ile karşılaştırıldığında,
atmosferik basınçlı plazma işlemi daha güçlü plazma enerjisine sahiptir, bu
nedenle uzaklaştırılan organik kirletici miktarının büyük olduğu söylenebilir.
Bu deneyde de benzer sonuçlar gösterilmiş ve plazma işleminin implant vidasının
yüzeyinden kirleticileri çıkardığı ve hidrofiliklik kazandırdığı görülmüştür.
Osseointegrasyonun hızlandırılması için titanyum yüzeylerin her zaman temiz
olması sağlanmalıdır. Çeşitli çalışmalarda ROS’un, malzemelerin yüzeyinde
adsorbe edilen organik kirleticileri ayrıştırma yeteneğine sahip olduğu
bildirilmiştir. İmplant tedavisi cerrahi prosedürleri içerdiğinden, implantı
çevreleyen dokuda oluşan iltihabın oksidatif strese bağlı olduğu
belirtilmektedir [48,49]. Aşırı miktarların hücre apoptozisine (hücre ölümüne)
ve doku iyileşmesini geciktirerek implant tedavisinin başarısız olmasına neden
olduğu bilinmektedir. Oksidatif stresin varlığı, implant yerleşimini çevreleyen
dokuda yeni kemik oluşumunu önleyebilir. Oksidatif stresin bastırılması,
RBMC'ler için iyi bir büyüme ortamı sağlar. Bu çalışmada, titanyum yüzeyinde
plazma işlemi ile aktif oksijen oluştuğu için oksidatif stresin azaldığı
açıklanmıştır. Bu nedenle, RBMC'lerin ilk davranışındaki değişikliğin ROS
baskılanması, kirleticilerin uzaklaştırılması ve süperhidrofilikliğin
kazandırılmasından kaynaklandığı sonucuna varılmıştır. Bu deneyde, RBMC'lerin
başlangıç davranışı, RBMC'lerle temastaki bir titanyum yüzeyinin SEM gözlemi
kullanılarak araştırılmıştır [40,50,51]. İşlenmemiş malzeme yüzeyinde, RBMC'ler
küresel bir morfoloji göstermiştir. Bununla birlikte, atmosferik basınçlı
plazma ile işlenen malzemenin yüzeyinde hücre çıkıntılarının uzaması
gözlemlenmiştir. RBMC'lerden osteoblastlara farklılaşma sürecinde aktin hücre
iskeletindeki yapısal değişikliklere eşlik eden hücre çekirdeğine bilgi
aktarımının önemli olduğu bildirilmiştir. Bu çalışmanın sonuçları benzerdir ve
önceki raporlarla birlikte, atmosferik basınçlı plazma işlemine tabi tutulan
titanyum yüzeyin RBMC'ler için bir büyüme ortamı olarak uygun olduğu
düşünülebilir. Bu çalışmada, titanyum yüzey, malzemenin yüzeyindeki
kirlilikleri uzaklaştırmak ve oksidatif stresi azaltmak için atmosferik
basınçlı plazma ile işlenerek hücrelerin kolayca büyüyebileceği bir ortam
oluşturulmuştur. RBMC'lerin kullanıldığı SEM analizinden, bu uygulamanı
RBMC'lerin yapışmasını desteklemede etkili olduğu açıklığa kavuşturulmuştur.
Bu çalışmanın in vivo
değerlendirmesinde kullanılan sıçan (rat) femur modeli, implant yüzeyinin
süngerimsi kemiğe temas ettiği arayüzde kemik dokusu oluşumunu değerlendirmek
içindir. Sıçanlarda yeni kemik oluşum
periyodu yaklaşık 8 haftadır ve bu, çalışmanın süresi açısından uygundur. Kemik
dokusuna temas eden implant yüzeyinin ilk reaksiyonunun, sonraki
osseointegrasyonda rol oynadığı düşünüldüğünden bu kez 4 hafta boyunca
değerlendirilmesi tarafımızdan tercih edilmiştir. Bu nedenle, bu çalışma
implantasyondan 4 ve 8 hafta sonra olmak üzere iki aşamada yürütülmüştür
[21,40,42,43]. Çeşitli çalışmalardan açıkça görülmektedir ki, in vivo düzeyde
bile, hidrofiliklik kazandırılan implant malzemesinin yüzeyindeki kemik bağı,
işlenmemiş implant malzemesinin yüzeyinden daha iyi olmuştur. Bu çalışma, tüm
in vivo değerlendirmelerde, atmosferik basınçlı plazma kullanılarak işlenen
titanyum vidalarla yüksek neoplastik kemik oluşumunu göstermiştir. Ujino ve
diğ., atmosferik basınçlı plazma ile işlenen titanyum plakanın, sert doku
farklılaşmasının indüklenmesi ile ilgili belirteçlerin ekspresyon seviyesini
iyileştirdiğini ortaya koymuştur [27]. Plazma ile işlenmiş implant malzemesinin
yüzeyindeki yeni kemik oluşumu, ilk kemik reaksiyonu ile yakından ilişkilidir
ve in vivo analiz ile tutarlı olduğu düşünülmektedir. 4. haftada yeni kemik
oluşumunda kesin bir fark gözlenmiştir. Ujino ve diğ. [27], materyalin yüzeyine
RBMC'lerin damlatılmasından 3 ila 4 hafta sonra kalsifikasyonun genetik
belirteçlerinde açık bir fark olduğunu göstermişlerdir. Kalsifikasyon hızındaki
bu artan eğilimin in vivo düzeyde bir farklılığa neden olduğu tahmin edilmektedir.
Yukarıda bahsedildiği gibi, in vitro ve in vivo çalışmalar bağdaşmaktadır ve
tarafımızdan yapılan önceki çalışmalarda kemik iliği hücrelerinin materyal
yüzeyindeki ilk davranışındaki değişiklikler, implantı çevreleyen dokudaki yeni
kemiğe aittir. Oluşum miktarında artışa dahil olduğu düşünülmektedir. Bu
deneyde kullanılan sıçanların hiçbirinde enfeksiyon gözlenmemiş ve sert doku
farklılaşmasını indükleme kabiliyetini yüksek tutarken antibakteriyel
özelliklere sahip oldukları açıklanmıştır. Uzun vadeli bir vizyondan yola
çıkarak bu yöntemin implant materyalleri için bir modifikasyon cihazı olarak
faydalı olması beklenebilir. Bununla birlikte, bu materyalin klinik ortamlarda
gerçekten yararlı olması için, av köpeği gibi büyük hayvanlar üzerinde yapılan
çalışmalara ihtiyaç vardır ve nihayetinde insanlara uygulanması düşünülmelidir.
Piezobrush'ın küçük ve nispeten basit olması nedeniyle klinisyenler için önemli
bir cihaz olacağı ve diş kliniklerinde kesinlikle yardımcı olacağı
öngörülmüştür.
Daha önceki çalışmalarda, saf
titanyum metal yüzeyinde piezobrush kullanılarak yapılan plazma uygulamasının
implantı çevreleyen dokuda sert doku oluşumuna katkıda bulunduğu tarafımızdan
in vitro düzeyde gösterilmişti.
4.1. Numune Hazırlama
Deney numuneleri iki gruba ayrılmıştır:
Atmosferik basınçlı plazma ile işlenmiş grup ve işlenmemiş grup. Bu çalışmada
in vitro titanyum numuneler (JIS Grade 2, 15 mm çap ve 1 mm kalınlık, Daido
Steel, Osaka, Japonya) ve titanyum vida implantları (1,2 mm dış çap ve 12 mm
uzunluk, Daido Steel, Osaka, Japonya) kullanılmıştır. Titanyum yüzey üzerindeki
plazma işlemleri, bir piezobrush® PZ2 (Relyon Plasma GmbH, Regensburg, Almanya)
kullanılarak gerçekleştirilmiştir. Plazma işlemi, atmosferik basınçlı, düşük
sıcaklıktaki plazma işlemiyle 10 mm'de 30 saniye boyunca ışınlama (0,2 MPa)
altında aktif gaz kullanılarak yapılmıştır. Titanyum yüzeyini gözlemlemek için
taramalı elektron mikroskobu (SEM, S-4800; Hitachi, Tokyo, Japonya) ve bir
taramalı prob mikroskobu (SPM, SPM-9600; SHIMADZU, Kyoto, Japonya)
kullanılmıştır. Numunelerin bileşenlerini analiz etmek için X-ışını
fotoelektron spektroskopisi (XPS) (Kratos Analytical Axis Ultra DLD elektron
spektrometresi; Kratos Instruments, Manchester, UK) kullanılmıştır. Test ve
kontrol implantlarının temas açısı ölçümleri, bir video temas açısı ölçüm
sistemi (SImage Entry 6; Excimer Inc., Kanagawa, Japonya) kullanılarak
yapılmıştır. Titanyum implantların yüzey işleminin hemen akabinde, 2,6 µL
damıtılmış su damlatıldıktan sonra ölçüm yapılmıştır.
4.2. Hücre Kültürü
Bu çalışmadaki hayvan deneyleri,
Osaka Dental Üniversitesi'ndeki hayvan deneyleri kılavuzlarına uygun olarak
gerçekleştirilmiştir (onay no. 20-08001). RBMC'ler, 8 haftalık Sprague-Dawley
(SD) sıçanlarının (SHIMIZU Laboratory Supplies Co., Kyoto, Japonya)
femurlarından elde edilmiştir. Sıçan uyluk kemiğinden birincil bir kemik iliği
hücresi kültürü oluşturma yöntemi, önceki yayınımızdaki şekilde uygulanmıştır.
Üçüncü nesil kemik iliği hücreleri, plazma ile işlenmiş ve işlenmemiş olan
titanyum içine ekilmiştir. Kültürleme için yine önceki yayınımızdaki yöntem
tercih edilmiştir.
4.3. Hücre Morfolojisi
RBMC'ler numuneler üzerine 4 x 104
hücre/cm2 yoğunlukta ekilmiştir. Bir hücrenin fosfat tamponlu
fizyolojik salin (PBS) ile yapıştırıldığı numuneler yıkanmış, %4 glutarik
aldehit ile sabitlenmiş ve 6 saatlik kültürden sonra adım adım etanol serisi
ile kurutulmuştur. Plazma işlemine tabi tutulmuş ve işlem görmemiş titanyum
yüzeye yapışan hücrenin formu SEM ile gözlemlenmiştir.
4.4. RBMC'lerin Hücre İçi ROS Düzeyi
Hücre içi ROS seviyeleri, CellROX®
oksidatif stres reaktifi (C10422, Thermo Fisher Life Technologies Ltd., Tokyo,
Japonya) kullanılarak belirlenmiştir. Test ve kontrol titanyum disklerinin
RBMC'ler üzerindeki ROS seviyeleri renklendirilmiş ve konfokal lazer tarama
mikroskobu (LSM 700, Carl Zeiss, City, Zeiss, Almanya) ile gözlemlenmiştir.
4.5. Sıçan Distal Femur Modeli In Vivo
Bu çalışmada 20 erkek SD sıçanı
(Shimizu Laboratory Supplies Co., Kyoto, Japonya; 8 haftalık, 160 ± 15 g
ağırlığında) kullanılmıştır (test grubu; 10 sıçan, kontrol grubu; 10 sıçan). Bu
çalışmadaki in vivo analiz, tarafımızdan yapılmış olan önceki çalışmalara
[21,24,42,43] dayanmaktadır. Hayvanlara inhalasyon anestezisi ve ardından
intraperitoneal anestezik enjeksiyonu (1.5 mL/kg) uygulanmıştır. Sağ arka
bacaktaki tüyler tıraş edilmiş ve cilt iyotla dezenfekte edilmiştir, ardından
bölge iyodu çıkarmak amacıyla %75 etanol ile temizlenmiştir. Diz ekleminin orta
kısmı boyunca 1 cm uzunluğunda longitudinal cilt kesisi yapılmış ve deri altı
bağ doku kesilmiştir. Dizkapağı ve uzatıcı kas mekanizmaları daha sonra femurun
distal görünümünü ortaya çıkarmak için parçalara ayrılmıştır. Bol steril salin
(madeni tuzlu ilaç) akışı altında 1 mm'lik yuvarlak diş frezi kullanılarak
interkondiler çentikten bir pilot delik açılmış ve delik bir endodontik eğe
(yumuşak doku törpüsü) ile 1,2 mm'ye genişletilmiştir. Etilen oksit gazı ile
sterilize edilen implantlar, hazırlanan 20 kanala ve sağ femurun medüller
(iliksi) boşluklarına rastgele yerleştirilmiştir. Ameliyattan sonra diz eklemi
restore edilmiş ve ameliyat bölgesi katmanlar halinde kapatılmıştır.
Hayvanlara, ameliyat sonrası enfeksiyonu önlemek ve ağrıyı hafifletmek için 3
gün boyunca gentamisin (1 mg/kg) ve buprenorfin (0.05 mg/kg) kas içi
enjeksiyonları yapılmıştır. Tüm sıçanların herhangi bir kısıtlama olmaksızın
serbest dolaşımına izin verilmiştir.
4.6. Ardışık Floresan Etiketleme
İmplantasyondan sonra yeni kemik
oluşumu ve mineralizasyon sürecini kaydetmek için intraperitoneal florokrom
enjeksiyonu kullanılarak kemiğin polikrom sıralı etiketlemesi aşağıdaki
programa göre yapılmıştır: 4. hafta, alizarin kırmızısı S 30 mg/kg (Sigma-Aldrich,
St. Louis, MO, ABD) ve 8. hafta, oksitetrasiklin hidroklorür 25 mg/kg
(Sigma-Aldrich, St. Louis, MO, ABD). Tüm hayvanlar, son etiketleme işleminden 3
gün sonra aşırı dozda intraperitoneal sodyum pentobarbital ile öldürülmüştür.
4.7. TNS Modifiye Titanyum Yüzeyde In Vivo Plazma Kaynaklı Kemik
Farklılaşması
Diseksiyondan (parçalara ayırma
işleminden) hemen sonra, implantlar da dahil olmak üzere sağ femurlar soğuk bir
salin solüsyonuna yerleştirilmiş ve 100 kV'da ve tüm uzaysal yönlerde 10 µm
piksel boyutunda çalıştırılan bir mikro bilgisayarlı tomografi tarayıcısı
(microCT, SkyScan 1275, Bruker, Kontich, Belçika) ile taranmıştır. Tomografik
kayıtlardan sonra, implant ve çevreleyen doku morfometrik yazılım (TRI/3D-BON;
Ratoc System Engineering, Tokyo, Japonya) kullanılarak yeniden yapılandırılmıi
ve analiz edilmiştir. ROI, büyüme plakasının en yüksek noktasının 2 mm altından
distal 100 dilime kadar implantların etrafındaki 500 µm genişliğindeki kemik
alanı olarak tanımlanmıştır [32]. ROI içinde kemik hacim fraksiyonu (BV/TV),
ortalama trabeküler sayı (Tb.N), ortalama trabeküler kalınlık (Tb.Th) ve
ortalama trabeküler ayrılma (Tb.Sp) hesaplanmıştır.
Mikro-CT taramasından sonra,
femoral numuneler, dekalsifiye edilmemiş histolojik kesitler oluşturmak için kullanılmıştır.
Numuneler 7 gün boyunca %70 etanol solüsyonunda sabitlenmiş, ardından
Villanueva kemik renklendiricisi solüsyonuna daldırılmıştır. Kesitler, bir
BZ-9000 dijital mikroskop (Keyence Co., Osaka, Japonya) kullanılarak
histomorfometrik olarak analiz edilmiştir. Floresan mikroskopisi aynı zamanda
bir konfokal lazer tarama mikroskobu (LSM 700, Carl Zeiss, Jena, Almanya)
kullanılarak da gerçekleştirilmiştir. Şelatlayıcı florokromların uyarma/emisyon
dalga boyları, alizarin kırmızısı S (kırmızı) ve oksitetrasiklin hidroklorür
(mavi) için sırasıyla 351/460 nm, 543/617 nm ve 488/517 nm’dir. Ölçüm bölgesi,
mikro-CT analizine uygun olarak büyüme plakasının yaklaşık 2 mm altından 1 mm
distale kadar olan bölümlerde tanımlanmıştır.
4.8. İstatistiksel Analiz
Tüm numunelerin dört kopyası
hazırlanmıştır. Veriler ortalama ± standart sapma olarak sunulmuştur. Tüm
analizlerde, eşleştirilmiş iki kuyruklu Student t testi (paired two tailed
Student’s t-test) kullanılarak istatistiksel anlamlılık belirlenmiştir. İstatistiksel
anlamlılık p < 0.05 olarak ayarlanmıştır. Çalışma tasarımı Şekil 12'de
gösterildiği gibi planlanmıştır.
Önceki çalışmalara ek olarak, bu
deneyin sonuçları, titanyum vidaya atmosferik basınçlı plazma işlemi
uygulanarak implantı çevreleyen dokuda yeni kemik oluşum miktarının arttığını
ortaya koymuştur. Bunun nedeni, atmosferik basınçlı plazma işleminin malzeme
yüzeyinin ıslanabilirliğini iyileştirmesi ve ROS'u düşürmesidir. Sonuç olarak,
in vivo değerlendirmede gösterilen sonuçla ilişkili görünen, malzeme yüzeyine
bağlanan RBMC'lerin yapışma mukavemetindeki iyileştirmenin indüklendiği
açıklığa kavuşturulmuştur. Bu cihaz hafif ve kullanımı kolay olduğu için
klinisyenlere tavsiye edilebilecek bir cihaz olarak önerilebilir.

Şekil 12. Çalışma tasarımının
gösterimi. Deneyler iki alana ayrılabilir. Biri titanyum yüzey üzerindeki
atmosferik basınçlı plazma işleminin malzeme yüzeyini nasıl etkilediğini
doğrulamaktır. Diğeri, sıçan uyluk kemiği kullanılarak yapılan bir in vivo
analizdir. İmplantasyondan dört hafta sonra, etiketli bir antikor olarak
alizarin kırmızısı enjekte edilmiş, sekiz haftada kalsein enjekte edilmiş ve
hastaya ötenazi uygulanmıştır. Femur implant ile birlikte çıkarılmış ve CT
analizi ile histolojik analiz yapılmıştır.
Yazar Katkıları: Kavramsallaştırma ve metodoloji,
S.K. ve H.N.; araştırma, H.T. ve S.T.; biçimsel analiz, H.T. ve AM; orjinal
taslağın yazımı, H.T. ve S.K. Tüm yazarlar makalenin yayınlanacak versiyonunu
okumuş ve kabul etmiştir.
Finansman: Bu çalışma, Japonya Bilimi Teşvik Derneği tarafından finanse
edilmiştir (hibe numaraları: 18K09713 ve 21K09966).
Bilgilendirilmiş Rıza Beyanı: Söz konusu değildir.
Veri Kullanılabilirlik Bildirimi: Bu çalışmada sunulan veriler, talep
üzerine ilgili yazardan temin edilebilir.
Teşekkür: Yazarlar, Hareketli Protez ve Oklüzyon Departmanına nazik
tavsiyeleri ve yardımları için teşekkür eder.
Çıkar Çatışması: Yazarlar herhangi bir çıkar çatışması beyan etmemektedir.
- Smeets,
R.; Stadlinger, B.; Schwarz, F.; Beck-Broichsitter, B.; Jung, O.; Precht,
C.; Kloss, F.; Gröbe, A.; Heiland, M.; Ebker, T. Impact of Dental Implant
Surface Modifications on Osseointegration. Biomed. Res. Int. 2016. [CrossRef]
- Liu,
X.; Chen, S.; Tsoi, J.K.H.; Matinlinna, J.P. Binary Titanium Alloys as
Dental Implant Materials—A Review. Regen. Biomater. 2017, 4, 315–323. [CrossRef]
[PubMed]
- Gehrke,
S.A.; Cavalcanti de Lima, J.H.; Rodriguez, F.; Calvo-Guirado, J.L.;
Aramburú Júnior, J.; Pérez-Díaz, L.; Mazón, P.; Aragoneses, J.M.; De Aza,
P.N. Microgrooves and Microrugosities in Titanium Implant Surfaces: An In
Vitro and In Vivo Evaluation. Materials 2019, 12, 1287. [CrossRef]
[PubMed]
- Yoshinari,
M.; Matsuzaka, K.; Inoue, T.; Oda, Y.; Shimono, M. Bio-functionalization
of titanium surfaces for dental implants. Mater. Trans. 2002, 43,
2494–2501. [CrossRef]
- Dohan
Ehrenfest, D.M.; Coelho, P.G.; Kang, B.-S.; Sul, Y.-T.; Albrektsson, T.
Classification of Osseointegrated Implant Surfaces: Materials, Chemistry
and Topography. Trends Biotechnol. 2010, 28, 198–206. [CrossRef]
- An,
N.; Rausch-fan, X.; Wieland, M.; Matejka, M.; Andrukhov, O.; Schedle, A.
Initial attachiment, subsequent cell proliferation/viability and gene
expression of epithelial cells related to attachment and wound healing in
response to different titanium surfaces. Dent. Mater. 2012, 28, 1207–1214.
[CrossRef] [PubMed]
- Zareidoost,
A.; Yousefpour, M.; Ghaseme, B.; Amanzadeh, A. The relationship of surface
roughness and cell response of chemical surface modification of titanium.
J. Mater. Sci. Mater. Med. 2012, 23, 1479–1488. [CrossRef]
- Huang,
H.-H.; Ho, C.-T.; Lee, T.-H.; Lee, T.-L.; Liao, K.-K.; Chen, F.-L. Effect
of surface roughness of ground titanium on initial cell adhesion. Biomol.
Eng. 2004, 21, 93–97. [CrossRef] [PubMed]
- Räisänen,
L.; Könönen, M.; Juhanoja, J.; Varpavaara, P.; Hautaniemi, J.; Kivilahti,
J.; Hormia, M. Expression of cell adhesion complexes in epithelial cells
seeded on biomaterial surfaces. J. Biomed. Mater. Res. 2000, 49, 79–87. [CrossRef]
- Lauer,
G.; Wiedmann-Al-Ahmad, M.; Otten, J.E.; Hübner, U.; Schmelzeisen, R.;
Schilli,W. The titanium surface texture effects adherence and growth of
human gingival keratinocytes and human maxillar osteoblast-like cells in
vitro. Biomaterials 2001, 22, 2799–2809. [CrossRef]
- Baharloo,
B.; Textor, M.; Brunette, D.M. Substratum roughness alters the growth,
area, and focal adhesions of epithelial cells, and their proximity to titanium
surfaces. J. Biomed. Mater. Res. Part A 2005, 74, 12–22. [CrossRef]
[PubMed]
- Wieland,
M.; Textor, M.; Spencer, N.D.; Brunette, D.M. Wavelength-dependent
roughness: A quantitative approach to characterizing the topography of
rough titanium surfaces. Int. J. Oral Maxillofac. Implants 2001, 16,
163–181.
- Boyan,
B.D.; Bonewald, L.F.; Paschalis, E.P.; Lohmann, C.H.; Rosser, J.; Cochran,
D.L.; Dean, D.D.; Schwartz, Z.; Boskey, A.L. Osteoblast-mediated mineral
deposition in culture is dependent on surface microtopography. Calcif.
Tissue Int. 2002, 71, 519–529. [CrossRef]
- Poh,
C.K.; Shi, Z.; Lim, T.Y.; Neoh, K.G.;Wang,W. The effect of VEGF
functionalization of titanium on endothelial cells in vitro. Biomaterialsl
2010, 31, 1578–1585. [CrossRef]
- Jayaraman,
M.; Meyer, U.; Bühner, M.; Joos, U.;Wiesmann, H.P. Influence of titanium
surfaces on attachment of osteoblast-like cells in vitro. Biomaterials
2004, 25, 625–631. [CrossRef]
- Komasa,
S.; Taguchi, Y.; Nishida, H.; Tanaka, M.; Kawazoe, T. Bioactivity of
nanostructure on titanium surface modified by chemical processing at room
temperature. J. Prosthodont. Res. 2012, 56, 170–177. [CrossRef]
[PubMed]
- Xing,
H.; Komasa, S.; Taguchi, Y.; Sekino, T.; Okazaki, J. Osteogenic activity
of titanium surface with nanonetwork structures. Int. J. Nanomed. 2014, 9,
1741–1755. [CrossRef] [PubMed]
- Fujino,
T.; Taguchi, Y.; Komasa, S.; Sekino, T.; Tanaka, M. Cell differentiation
on nanoscale feature of a titanium surface: Effects of deposition tme in
NaOH solution. J. Hard Tissue Boil. 2014, 23, 63–70. [CrossRef]
- Nakano,
Y.; Komasa, S.; Taguchi, Y.; Sekino, T.; Okazaki, J. Rat endothelial cell
attachment, behavior and gene expression on NaOH-treated titanium surfaces.
J. Oral Tissue Eng. 2013, 11, 189–200.
- Hara,
Y.; Komasa, S.; Yoshimine, S.; Nisizaki, H.; Okazaki, J. Effect of Nano
modified titanium surface on adsorption of rat periodontal ligament cells.
J. Osaka Dent. Univ. 2018, 52, 37–44.
- Terada,
C.; Komasa, S.; Kusumoto, T.; Kawazoe, T.; Okazaki, J. Effect of
amelogenin coating of a nano-modified titanium surface on bioactivity.
Int. J. Mol. Sci. 2018, 19, 1274. [CrossRef] [PubMed]
- Zhang,
H.; Komasa, S.; Mashimo, C.; Sekino, T.; Okazaki, J. Effect of ultraviolet
treatment on bacterial attachment and osteogenic activity to
alkali-treated titanium with nanonetwork structures. Int. J. Nanomed.
2017, 12, 4633–4646. [CrossRef] [PubMed]
- Nishizaki,
M.; Komasa, S.; Taguchi, Y.; Nishizaki, H.; Okazaki, J. Bioactivity of
NANOZR induced by alkali treatment. Int. J. Mol. Sci. 2017, 18, 780. [CrossRef]
- Komasa,
S.; Nishizaki, M.; Zhang, H.; Takao, S.; Yin, D.; Terada, C.; Kobayashi,
Y.; Kusumoto, T.; Yoshimine, S.; Nishizaki, H.; et al. Osseointegration of
alkali-modified NANOZR implants: An in vivo study. Int. J. Mol. Sci. 2019,
20, 842. [CrossRef] [PubMed]
- Komasa,
S.; Nisizaki, M.; Kusumoto, T.; Terada, C.; Derong, Y.; Kawamoto, A.;
Yamamoto, S.; Yoshimine, S.; Nisizaki, H.; Shimizu, H.; et al.
Osteogenesis-related gene expression on alkalimodified NANOZR and titanium
surfaces with nanonetwork structures. J. Bio-Integr. 2017, 7, 87–94.
- Stevens,
N.; Priest, C.I.; Sedev, R.; Ralston, J. Wettability of photoresponsive
titanium dioxide surfaces. Langmuir 2003, 19, 3272–3275. [CrossRef]
- Adawiyah,
J.H.; Zainab, N.J.; Imad, H.M.; Al-Hussaini, I.H. Review on: Titanium
dioxide applications. Energy Procedia 2019, 157, 17–29.
- Ohler,
B.; Langel, W. Molecular Dynamics Simulations on the Interface between
Titanium Dioxide and Water Droplets: A New Model for the Contact Angle. J.
Phys. Chem. C 2009, 113, 10189–10197. [CrossRef]
- Rupp,
F.; Scheideler, L.; Olshanska, N.; de Wild, M.; Wielden, M.;
Geis-Gerstorfer, J. Enhancing surface free energy and hydrophilicity
through chemical modification of micro structured titanium implant
surfaces. J. Biomed. Mater. Res. 2006, 76, 323–334. [CrossRef]
[PubMed]
- Zhao,
G.; Schwartz, Z.;Wieland, M.; Rupp, F.; Geis-Gerstorfer, J.; Cochran,
D.L.; Boyan, B.D. High surface energy enhances cell response to titanium
substrate microstructure. J. Biomed. Mater. Res. Part A 2005, 74, 49–58. [CrossRef]
- Aita,
H.; Hori, N.; Takeuchi, M.; Suzuki, T.; Yamada, M.; Anpo, M.; Ogawa, T.
The effect of ultraviolet functionalization of titanium on integration
with bone. Biomaterials 2009, 30, 1015–1025. [CrossRef]
- Aita,
H.; Att, W.; Ueno, T.; Yamada, M.; Hori, N.; Iwasa, F.; Tsukimura, N.;
Ogawa, T. Ultraviolet light-mediated photofunctionalization of titanium to
promote human mesenchymal stem cell migration, attachment, proliferation
and differentiation. Acta Biomater. 2009, 5, 3247–3257. [CrossRef]
- Fridman,
G.; Friedman, G.; Gutsol, A.; Shekhter, A.B.; Vasilets, V.N.; Fridman, A.
Applied plasma medicine. Plasma Process Polym. 2008, 5, 503–533. [CrossRef]
- Schröder,
K.; Finke, B.; Polak, M.; Lüthen, F.; Nebe, B.; Rychly, J.; Bader, R.;
Lukowski, G.; Walschus, U.; Schlosser, M.; et al. Gas-discharge
plasma-assisted functionalization of titanium implant surfaces. Mater.
Sci. Forum 2010, 638–642, 700–705. [CrossRef]
- Coelho,
P.G.; Giro, G.; Teixeira, H.S.; Marin, C.;Witek, L.; Thompson, V.P.;
Tovar, N.; Silva, N.R.F.A. Argon-based atmospheric pressure plasma
enhances early bone response to rough titanium surfaces. Journal of
Biomedical Materials Research Part A 2012, 100A, 1901–1906. [CrossRef]
[PubMed]
- Yeung,
K.W.K.; Chan, R.Y.L.; Lam, K.O.; Wu, S.L.; Liu, X.M.; Chung, C.Y.; Chu,
P.K.; Lu, W.W.; Chan, D.; Luk, K.D.K.; et al. In vitro and in vivo
characterization of novel plasma treated nickel titanium shape memory
alloy for orthopedic implantation. Surf. Coat. Technol. 2007, 202,
1247–1251. [CrossRef]
- Matsumoto,
T.; Tashiro, Y.; Komasa, S.; Miyake, A.; Komasa, Y.; Okazaki, J. Effect of
modification on adsorption behavior f cell and protein on titanium surface
by using quartz crystal microbalance system. Materials 2021, 14, 97. [CrossRef]
- Perrin,
D.; Szmukler-Moncler, S.; Echikou, C.; Pointaire, P.; Bernard, J.P. Bone
response to alteration of surface topography and surface composition of
sandblasted and acid etched (SLA) implants. Clin Oral Implants Res 2002,
13, 465–469. [CrossRef]
- Foest,
R.; Kindel, E.; Ohl, A.; Stieber, M.; Weltmann, K.-D. Non-thermal
atmospheric pressure discharges for surface modification. Plasma Phys.
Control. Fusion 2005, 47, B525–B536. [CrossRef]
- Duske,
K.; Koban, I.; Kindel, E.; Schröder, K.; Nebe, B.; Holtfreter, B.;
Jablonowski, L.;Weltmann, K.D.; Kocher, T. Atmospheric plasma enhances
wettability and cell spreading on dental implant metals. J. Clin.
Periodontol. 2012, 39, 400–407. [CrossRef]
- Ujino,
D.; Nisizaki, H.; Higuchi, S.; Komasa, S.; Okazaki, J. Effect of plasma
treatment of titanium surface on bioactivity. Appl. Sci. 2019, 9, 2257. [CrossRef]
- Takao,
S.; Komasa, S.; Agariguchi, A.; Kusumoto, T.; Pezzotti, G.; Okazaki, J.
Effects of plasma treatment on the bioactivity of alkali-treated
ceria-stabilised zirconia/alumina nanocomposite (NANOZR). Int. J. Mol.
Sci. 2020, 21, 7476. [CrossRef]
- Zeng,
Y.; Komasa, S.; Nishida, H.; Agariguchi, A.; Sekino, T.; Okazaki, J.
Enhanced osseointegration and bio-decontamination of nanostructured
titanium, based on non-thermal atmospheric pressure plasma. Int. J. Mol.
Sci. 2020, 21, 3533. [CrossRef]
- Toffoli,
A.; Parisi, L.; Tatti, R.; Lorenzi, A.; Verucchi, R.; Manfredi, E.;
Lumetti, S.; Macaluso, G.M. Thermal-induced hydrophilicity enhancement of
titanium dental implant surfaces. J. Oral Sci. 2020, 62, 217–221. [CrossRef]
- Guastaldi,
F.P.S.; Yoo, D.; Marin, C.; Jimbo, R.; Tavor, N.; Zanetta-Barbosa, D.;
Chelho, P.G. Plasma treatment maintains surface energy of the implant
surface and enhances osseointegration. Int. J. Biomater. 2013. [CrossRef]
- Tallarico,
M.; Baldini, N.; Gatti, F.; Martinolli, M.; Xhanari, E.; Meloni, S.M.;
Gabriele, C.; Immacolata, L.A. Role of new hydrophilic surfaces on early
success rate and implantstability: 1-year post-loading results of a
multicenter, split-mouth, randomized controlled trial. Eur. J. Dent. 2021,
15, 001–007. [CrossRef]
- Park,
J.-W.; Jang, J.-H.; Lee, C.S.; Hanawa, T. Osteoconductivity of hydrophilic
microstructured titanium implants with phosphate ion chemistry. Acta
Biomater. 2009, 5, 2311–2321. [CrossRef]
- Basu,
S.; Michaëlsson, K.; Olofsson, H.; Johansson, S.; Melhus, H. Association
between oxidative stress and bone mineral density. Biochem. Biophys. Res.
Commun. 2001, 288, 275–279. [CrossRef] [PubMed]
- Liu,
S.; Xu, L.; Zhang, T.; Ren, G.; Yang, Z. Oxidative stress and apoptosis
induced by nanosized titanium dioxide in PC12 cells. Toxicology 2010, 267,
172–177. [CrossRef] [PubMed]
- Lee,
J.-H.; Jeong, W.-S.; Seo, S.-J.; Kim, H.-W.; Kim, K.-N.; Choi, E.-H.; Kim,
K.-M. Non-thermal atmospheric pressure plasma functionalized dental
implant for enhancement of bacterial resistance and osseointegration.
Dent. Mater. 2017, 33, 257–270. [CrossRef] [PubMed]
- Leon-Ramos,
J.-R.; Diosdado-Cano, J.-M.; López-Santos, C.; Barranco, A.;
Torres-Lagares, D.; Serrera-Figallo, M.-A. Influence of titanium oxide
pillar array nanometric structure and ultraviolet irradiation on the
properties of the surface of dental implants—A pilot study. Nanomaterials
2019, 9, 1458. [CrossRef] [PubMed]












